Por Nikko Médici el 21 de enero de 2021. Editado el 16 de febrero de 2021.
En publicaciones anteriores se presentaron de forma general
los productos y medios principales y más comunes utilizados como antisépticos,
desinfectantes y esterilizantes. Con esta publicación se continúa tratando de
forma individual, con más detalles y un poco más profundo cada uno de los
productos y medios antes presentados.
En esta publicación se tratan “El cloro y compuestos
clorados” y los tópicos que se describen son:
-
Usos.
-
Concentración (porcentaje de utilización). Cómo diluir
(pasar de más concentrado a menos concentrado).
-
Mecanismo de acción.
-
Espectro de acción.
-
Indicaciones.
-
Efectos adversos o efectos secundarios.
-
Ventajas y desventajas.
-
Precauciones.
La eficacia y seguridad de la desinfección requiere del
monitoreo estricto de parámetros y de procedimientos escritos con la operatoria
de trabajo detallada; debiéndose registrar los controles químicos (control de
concentración con tiras químicas reactivas) y controles físicos (temperatura y
tiempo de exposición) efectuados sobre la solución desinfectante.
La limpieza debe ser realizada en todo material, precediendo
al proceso de desinfección.
La suciedad actúa protegiendo a los microorganismos del
contacto con agentes letales (desinfectantes, esterilizantes) y reaccionan e
inactivan los agentes de limpieza. La limpieza física elimina grandes
cantidades de organismos asociados con la suciedad. Las prácticas de limpieza
seguras son importantes para reducir la carga microbiana de las superficies.
En la publicación:
Podrá consultar los siguientes conceptos: • Organismo. • Germen (gérmenes). • Virus. • Bacterias.
• Hongos.
En la publicación:
Podrá consultar los
siguientes conceptos: • Microorganismo. • Patógeno. • Antisépticos. • Infección.
• Desinfección. • Desinfectantes. • Limpieza. • Microbicida. • Antisepsia. • Germicida. • Viricida. •
Bactericida. • Asepsia. • Antibacteriano/antibacterial. • Antimicrobiano, a.
Son los desinfectantes de mediano nivel (nivel medio) más
económicos, efectivos e inocuos para el hombre [3].
Pueden presentarse como cloro puro, combinado como cloramina T o
en sus formas más utilizadas: hipoclorito de sodio (en solución acuosa) o de
calcio (en tabletas y polvos). El principio activo de todos es el mismo: la
liberación de cloro molecular, que en presencia de agua se combina con esta
para formar ácido hipocloroso (HClO), el cual es un fuerte agente oxidante a pH
neutro o ácido [3][6].
Cl2
+ H2O à HClO
+ Cl- + H+
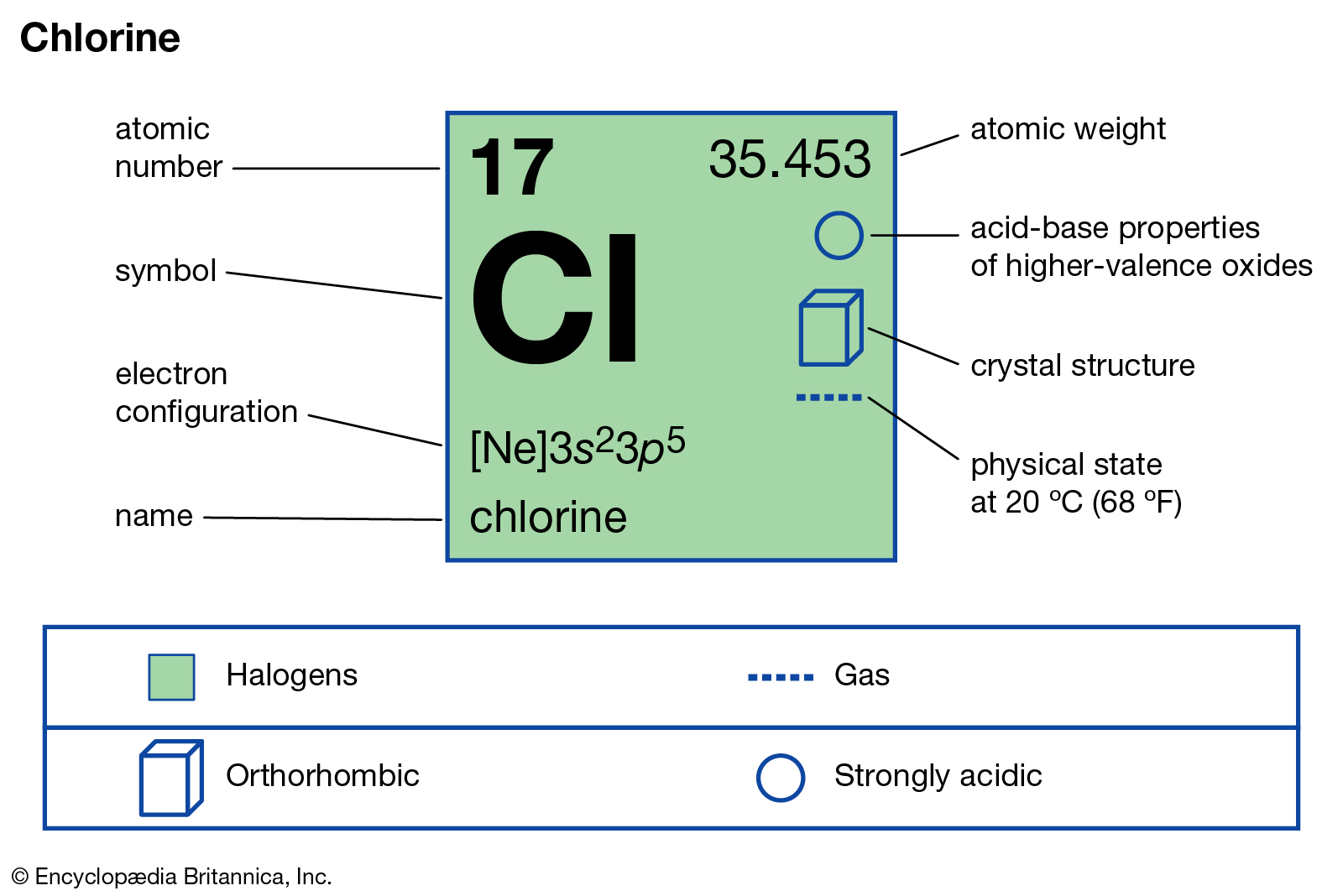
El cloro, pertenece a la familia de los compuestos halogenados.
Los compuestos de cloro son los desinfectantes más utilizados a nivel
industrial y no tiene comparación con otro igual en el tratamiento de las
aguas. El principio activo, cloro, se puede presentar en forma gaseosa,
soluciones de hipoclorito y cloramina T [1]. Los desinfectantes basados en el
cloro generalmente están disponibles en forma gaseosa, líquida como hipoclorito
de sodio (en algunos lugares conocido como lejía), o sólida como hipoclorito de
calcio y dicloroisocianurato de sodio [6][11][14]. El
cloro está formado por moléculas diatómicas: a temperatura ambiente el cloro es
un gas de color amarillo verdoso. El gas de cloro es dos veces y media más
pesado que el aire, tiene un olor sofocante intensamente desagradable y es
extremadamente tóxico. En su forma líquida y sólida es un poderoso agente
oxidante, blanqueador y desinfectante [1].
El mecanismo de acción sobre los microorganismos es poco conocido
[1][6]. Su acción produce inhibición de las reacciones enzimáticas, desnaturalización
de las proteínas [1][6][11] e inactivación de los ácidos nucleicos [11]. En
cualquier caso, el mecanismo por el cual desarrolla la acción desinfectante se
debe a la liberación de cloro libre que a su vez, junto al agua y en medio
ácido o neutro, origina ácido hipocloroso que es un oxidante fuerte que se
combina con el grupo amino de las proteínas bacterianas para formar cloraminas
y liberar oxígeno (destruye los microorganismos por oxidación) [14]. Actúa
por oxidación de los componentes celulares [2][6]. Si bien actúa mejor a
pH neutro o ácido, es más estable a pH 8 [3].
Se trata de potentes germicidas inespecíficos de acción rápida
contra bacterias y virus, aunque su actividad disminuye al entrar en contacto
con materia orgánica y al aumentar el pH (en solución alcalina se forman iones hipoclorito)
[14]. Viricida {destruye los virus envueltos, ej.: virus de la inmunodeficiencia humana (VIH). También
algunos desnudos, ej.: virus de la hepatitis B (VHB). [3]},
fungicida, bactericida (micobactericida) en concentraciones altas, >260 ppm, son
esporicidas [6][10][11], actividad variable contra esporas [3][10],
tuberculicida [3]. Mata a la mayoría de las células vegetativas [2].
Los hipocloritos tienen un extenso espectro de actividad, son
bactericidas, viricidas, fungicidas y esporicidas, pero con actividad variable
frente a micobacterias, según la concentración en que se use [1]. Se ha
demostrado que el ácido hipocloroso (HClO) es responsable de la destrucción de
los microorganismos [1][6].
La concentración de cloro activo se mide en partes por millón (ppm)
o gramos por litro (g/l), de modo que 1000 ppm=1 g/l, o lo que es lo
mismo 1 ppm=1 mg/l. [3]
La concentración mínima para eliminar las micobacterias es de 1000
ppm (0.1 %) durante 10 minutos. No deben sumergirse objetos por más de 30 minutos
debido a su actividad corrosiva. Se recomienda además, el enjuague
abundante para evitar irritación química debido a los posibles residuos. Es
importante señalar que existen muchos factores que afectan la estabilidad del
cloro, tales como la presencia de iones pesados, pH de la solución, temperatura
de la solución, presencia de biofilmes, presencia de materias orgánicas y
radiación ultravioleta. [11]
Fórmula para preparar una solución de hipoclorito [11]:
cc =
Litros de agua x ppm / Concentración de compra
(es
una adaptación de [V1 = V2 · C2 / C1], para hacer la dilución de una
solución concentrada de hipoclorito de sodio utilizamos la ecuación:
C1 ·
V1 = C2 · V2 [3])
Donde:
cc: centímetros cúbicos de hipoclorito de sodio a agregar a la
preparación (equivale a V1).
Litros de agua: cantidad de solución final a preparar (equivale a
V2).
ppm: partes por millón (concentración final a preparar, equivale a
C2).
C1 = concentración inicial (concentración de compra).
V1 = volumen inicial de tu “cloro” con C1 que debes mezclar con
agua para obtener tu “cloro” con C2.
C2 = concentración final que quieres obtener de tu “cloro”.
V2 = volumen final que quieres obtener de tu “cloro” con C2.
Así, para preparar 100 ml de “cloro” al 1 % (10 000 ppm)
a partir de un “cloro” que tú compres en un supermercado con 5.25 % (52
500 ppm) tenemos:
5.25 % · V1 = 1 % · 100 ml
Despejando V1 tenemos: V1 = 1 % · 100 ml / 5.25 % = 19.0
ml
A esta cantidad (19.0 ml) se le agrega agua destilada hasta
completar los 100 ml y así tener tu cloro al 1 %. [3]
Otro ejemplo [3]: partiendo de una solución al 4 % se
necesita preparar 1 L de solución de hipoclorito de sodio que contenga
2500 ppm de cloro activo para preparar un bocal.
C1= 40 000 ppm
(4 %).
V1= x
C2= 2500 ppm
(0.25 %).
V2= 1000 ml (1 L)
Entonces tenemos: 40 000 ppm · V1 = 2500 ppm · 1000 ml
Despejando: V1 = 2500 ppm · 1000 ml / 40 000 ppm = 62.5 ml.
Se deben tomar 62.5 ml de solución concentrada y agregarle agua hasta
completar 1 L.
Otras formas para diluir una solución de hipoclorito se encuentran
en [1] he aquí un ejemplo de esas otras:
A partir de una
Solución comercial: solución de cloro concentrada al 5.0 %,
obtener una
Solución deseada: solución de cloro diluida al 0.5 % (5000
ppm).
Fórmula: [5.0 % ÷ 0.5 %] – 1
-> 10 – 1 = 9
Es decir,
Debes agregar 9 partes de agua a una parte de solución comercial de cloro al 5.0 %. [1]
Concentración de compra más utilizados[11]:
• Casera 5.25 %.
• Concentrada 10 %.
• Piscinas 12 %.
Concentraciones de uso en el ámbito hospitalario [11]:
10 000 ppm = 1 % = Concentración para desinfección
de derrames, previa limpieza.
5000 ppm = 0.5 % = Desinfección de materiales, previa
limpieza.
1000 ppm = 0.1 % = Desinfección de áreas críticas,
previa limpieza.
100 ppm a 500 ppm = 0.01 % a 0.05 % =
Desinfección de áreas no críticas.
Según la
cantidad de cloro activo y el uso que le vamos a dar, es la dilución que
debemos hacer [3]:
• Chatas,
violines o heridas muy sucias: 5000 ppm.
• Bocales con pipetas contaminadas: 2500 ppm. (Bocal:
recipiente de vidrio, de cuello ancho y corto usado en laboratorios, farmacias,
hospitales, etc. [12]).
• Mamaderas o
heridas en general: 1000 ppm.
• Frutas,
verduras, vajilla, ropa blanca: 250 ppm.
• Potabilización
del agua: 2 ppm.
Algunas equivalencias
útiles son:
• 1 cucharada
de sopa = 25 ml.
• 1
cucharadita de té = 5 ml.
• 1 gota =
0.05 ml.
Hipoclorito sódico (hipoclorito de sodio): La
solución de hipoclorito sódico es muy potente como desinfectante para uso
externo (ataca a virus y bacterias)[5][6][1][14]. Se emplea en desinfección de
paredes, pisos, sanitarios, recipientes de alimentos, útiles de aseo, etc. El
hipoclorito comercial se vende a concentraciones del 10 % al 17 %.
Hay que tener en cuenta que el cloro activo que pueda contener el producto en
el momento de uso puede ser bastante variable. El hipoclorito podría utilizarse
con la doble función de limpieza y desinfección a concentraciones del 5 % al
10 %. Las soluciones a pH alcalino (con bicarbonato sódico) son más estables
pero a pH ácido tienen mayor actividad [14], el hipoclorito sódico a
concentraciones de 1000 ppm (0.1 %) es el biocida más eficaz en la
limpieza y desinfección de superficies contaminadas [10], las
soluciones de hipoclorito se usan para desinfectar objetos y superficies [2],
las soluciones de hipoclorito de sodio son ampliamente utilizadas para la
desinfección de superficies duras (blanqueadores domésticos) y pueden usarse
para desinfectar derrames de sangre que contienen virus de inmunodeficiencia
humana o virus de hepatitis B [1][6]. No deja residuos tóxicos, es barato
y de rápida acción. Puede producir irritación ocular u oro-faríngea, esofágica
y quemaduras gástricas. Al mezclarlo con otros agentes libera gas clorado
tóxico y disminuye su estabilidad [1].
Cloraminas: son derivados orgánicos del cloro, de
actividad algo inferior al hipoclorito sódico, pero con menos poder irritante
sobre la piel, ya que liberan el cloro de forma gradual. Esta liberación puede
ser en forma de cloro (cuando el medio es ácido) y en forma de ácido
hipocloroso (en medio neutro). La cloramina T se emplea en el lavado de heridas
y como antiséptico quirúrgico o irrigaciones vaginales [14]. Cloramina T (cloramicina)
derivado clorado que contiene 25 % de cloro disponible. Se inactiva en
presencia de materia orgánica, pero su actividad bactericida se mantiene más
tiempo que en el caso de los hipocloritos. Se utiliza en la desinfección de
agua de bebida [1].
Dióxido de cloro: está protegido en soluciones
acuosas, añadiendo ácido hasta una requerida concentración se activa el
desinfectante [1]. El dióxido de cloro es un gas de color amarillo o
amarillo-rojizo que se descompone rápidamente en el aire. Debido a que es un
gas peligroso, el dióxido de cloro siempre se manufactura en el lugar donde
habrá de usarse. El dióxido de cloro se usa como blanqueador en las fábricas
que producen papel y productos de papel y en las plantas de tratamiento de agua
que producen agua potable. El dióxido de cloro también se ha usado para
descontaminar edificios públicos. El dióxido de cloro es soluble en agua y
reacciona rápidamente con otros compuestos. Cuando reacciona en el agua, el
dióxido de cloro forma iones de clorito, los cuales son también sustancias muy
reactivas. La alta reactividad del dióxido de cloro le permite matar bacterias
y otros microorganismos en el agua [7].
Dicloroisocianurato de sodio (NaDCC). Tiene como ventaja la
facilidad en la dilución correcta y en la estabilidad del producto, ya que se
prepara al momento de ser usado. Se emplea como desinfectante de uso
hospitalario [1]. Llamado también sal sódica de dicloro,
tricloseno de sodio, dihidrato, etc. Se presenta
en forma de pastillas (2 g-5 g) o gránulos (99 %-100 %),
que al disolverse en agua liberan ácido hipocloroso. Contiene aproximadamente
65 % de cloro libre disponible (también llamado “cloro activo”). Presenta
las mismas propiedades generales que el hipoclorito, pero con las
ventajas de una mayor estabilidad (antes de disolver en agua), mayor actividad,
una menor inactivación por materia orgánica y una mayor exactitud en la
preparación de las diluciones. Una desventaja es ser corrosivo para los
metales, algunos plásticos y el caucho [1][6].
El tiempo de acción de estos productos dependerá de la
concentración y el pH de la solución. El tiempo de exposición puede ir desde
segundos a horas. Ejemplo: concentraciones de 25 ppm (0.002 5 %)
tienen un efecto biocida en Mycoplasma spp y concentraciones <5 ppm
(0.000 5 %) en bacterias vegetativas en un tiempo de acción de
segundos en ausencia de materia orgánica. Para eliminar Mycobacterium
tuberculosis se requiere concentraciones de 1000 ppm
(0.1 %). Una concentración de 100 ppm (0.01 %) eliminará 99.9 %
de las esporas de Bacillus atrophaeus dentro
de 5 min y agentes micóticos (hongos) en menos de una hora [1].
Las soluciones en base a cloro se pueden utilizar para
desinfección, siempre y cuando los materiales sean compatibles con cloro y
estén libres de materia orgánica; en caso contrario, se debe limpiar antes de
utilizar la solución desinfectante [1].
Las principales complicaciones están relacionadas directamente con
las personas que manipulan estas sustancias. No se debe olvidar:
• El cloro se considera una sustancia química irritante del
sistema respiratorio, las membranas mucosas y de la piel [1][2][4][5][11].
• El cloro líquido causa fuertes quemaduras al contacto con la
piel y en los ojos. Los efectos son más graves a medida que es más alta la
concentración y mayor tiempo de exposición, ocasionado irritación a ojos y
dificultad para respirar [1].
• Los síntomas de la exposición a altas concentraciones consisten
en náuseas y vómitos, seguidos de una notoria dificultad para respirar [1].
• El cloro no produce efectos acumulativos conocidos y todas las
molestias que ocasionan son consecuencia directa o indirecta de su acción
irritante local [1].
• Corrosivo para los metales [2][4][8][11].
Su acción es rápida, de bajo costo y de fácil manejo. Tiene
propiedades desodorizantes y actividad microbicida atribuible al ácido
hipocloroso no disociado. La disociación de este ácido, y por consiguiente la
menor actividad, depende del pH. Su eficiencia disminuye por el aumento del pH.
Se polimeriza por los rayos de sol y necesita estar protegido en envases
opacos. Las soluciones de cloro no deben conservarse en envases destapados por
más de 12 horas debido a la evaporación del producto activo, haciendo que las
concentraciones de cloro disponible disminuyan de 40 % a 50 % [11].
Se inactiva en presencia de materia orgánica [1][2][3][5][8][10] [11]
Es importante considerar que las soluciones cloradas deben ser
preparadas diariamente, con instrucciones precisas y supervisión, para que la
dilución sea la correcta. Las superficies ambientales contaminadas con sangre u
otros fluidos corporales o visiblemente sucias deben ser limpiadas antes de
utilizar el desinfectante ya que se inactiva frente a materia orgánica. Los envases
deben ser opacos, no exponerlos a luz ya que se inactivan y se deben mantener
cerrados. NO MEZCLAR CON DETERGENTES ya que pierde su efectividad [1] y genera
productos tóxicos para el ser humano.
Las diluciones acuosas se degradan más rápidamente que las soluciones
concentradas. Por lo tanto, para conservar productos clorados, es necesario mantenerlos
en recipientes opacos, sin materia orgánica, lo más puro posible y a pH 8. Aun
con todas estas precauciones, los productos así preparados deben renovarse al
menos una vez al mes [3].
Las diluciones en agua tibia actúan más rápida e intensamente que
en agua fría, pero se degradan pronto. No es recomendable combinar estas
soluciones con detergentes, los cuales pueden inactivarlas (sobre todo los catiónicos).
No obstante, es aconsejable limpiar previamente con un detergente las
superficies a desinfectar, para eliminar restos orgánicos [3].
1. Alexis
Diomedi et al. Antisépticos y desinfectantes: apuntando al uso racional. Recomendaciones del Comité Consultivo de
Infecciones Asociadas a la Atención de
Salud, Sociedad Chilena de Infectología. Revista chilena de infectología,
2017. Págs. 156-174, vol. 34, ISSN: 0716-1018.
http://dx.doi.org/10.4067/S0716-10182017000200010
2. Limpieza,
desinfección, esterilización y antisepsia.
http://www.ucv.ve/fileadmin/user_upload/facultad_farmacia/catedraMicro/08_Tema_14_Limpieza__desinfecci%C3%B3n.pdf
(19/4/2020).
3. R.
Vignoli. Esterilización, desinfección y antisepsia.
http://www.higiene.edu.uy/cefa/2008/esterilizacionydesinfeccion.pdf
(19/4/2020).
4. NTP
429: Desinfectantes: características y usos más corrientes. Ministerio de
Trabajo y Asuntos Sociales de España.
5. Nekane
Bilbao. Antisépticos y desinfectantes. Farmacia profesional, 2009.
Págs. 37-39, vol. 23.
https://www.elsevier.es/es-revista-farmacia-profesional-3-articulo-antisepticos-desinfectantes-13139886
(3/4/2020).
6.
Gerald
McDonnell y A. Denver Russell. Antiseptics and Disinfectants: Activity, Action,
and Resistance. Clinical microbiology reviews, 1999. Págs. 147-179, vol. 12.
ISSN: 0893-8512.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC88911/
(4/4/2020).
7. Agencia
para Sustancias Tóxicas y el Registro de Enfermedades. (ATSDR). 2004. Reseña Toxicológica
del Dióxido de Cloro y Clorito (en inglés). Atlanta, GA: Departamento de Salud
y Servicios Humanos de EE. UU., Servicio de Salud Pública.
https://www.atsdr.cdc.gov/es/phs/es_phs160.html
(3/5/2020).
8. Antisépticos
y desinfectantes. [En línea]
http://www6.uc.cl/manejoheridas/html/antiseptico.html
(3/5/2020).
9.
10.
María-Jesús Hernández-Navarrete, José-Miguel Celorrio-Pascual, Carlos Lapresta Moros, Victor-Manuel
Solano Bernad. Fundamentos de antisepsia, desinfección y esterilización, 2014.
Págs. 681-688, vol. 32.
http://dx.doi.org/10.1016/j.eimc.2014.04.003
11.
Silvia I. Acosta-Gnass y Valeska de Andrade
Stempliuk. Manual de esterilización para centros de salud. Organización
Panamericana de la Salud (OPS).
http://www1.paho.org/PAHO-USAID/dmdocuments/AMR-Manual_Esterilizacion_Centros_Salud_2008.pdf
(3/4/2020).
12.
Diccionario de la lengua española (DEL) de la
Real Academia Española (RAE). https://dle.rae.es/
(3/5/2020).
13.
Universidad de Salamanca. Diccionario
médico-biológico, histórico y etimológico (Dicciomed).
https://dicciomed.usal.es/palabra/antimicrobiano-na
(19/4/2020).
14.
Laura González Bosquet. Antisépticos y
desinfectantes. Offarm, 2003. Págs. 64-70, vol. 22.
Nikko Médici
Ingeniero químico.
Especialidad en tecnología de alimentos.
Especialidad en calidad y tratamiento de agua.
Maestría en gestión y auditorías ambientales. Orientación en ingeniería y tecnología ambiental.
Maestría en ingeniería térmica.
Doctor (Ph. D.) en eficiencia energética y sostenibilidad en ingeniería y arquitectura.
Gerente general e investigador científico jefe en CIENCIA EQUIS.
CIENCIA EQUIS puede ayudarte, tu incógnita o problema nosotros lo resolvemos. No dudes en contactarnos. También pregunta por nuestros servicios internacionales de asesoría, consultoría, diseño y cálculo.
© Copyright CIENCIA EQUIS by Willerenver Terrero.
Haga un comentario